Poznavanje definicij v fiziki je ključni dejavnik za uspešno reševanje različnih fizičnih problemov. V članku bomo obravnavali, kaj pomenijo izobarični, izohorični, izotermični in adiabatski procesi za idealni plinski sistem.
Idealni plin in njegova enačba
Preden nadaljujemo z opisom izobaričnih, izohoričnih in izotermičnih procesov, razmislimo, kaj je idealen plin. Pod to definicijo v fiziki obravnavajo sistem, sestavljen iz ogromnega števila brezdimenzionalnih in medsebojno delujočih delcev, ki se premikajo z velikimi hitrostmi v vseh smereh. Pravzaprav govorimo o plinastem agregatnem stanju snovi, v katerem razdalje med atomi in molekulami močno presegajo njihove velikosti in pri katerem je potencialna energija interakcije delcev zaradi svoje majhnosti v primerjavi s kinetično energijo zanemarjena.
Stanje idealnega plina je celota njegovih termodinamičnih parametrov. Glavni so temperatura, prostornina in tlak. Označimo jih s črkami T, V in P. V 30-ih letih XIX stoletjaClapeyron (francoski znanstvenik) je najprej zapisal enačbo, ki združuje navedene termodinamične parametre znotraj ene enačbe. Izgleda tako:
PV=nRT,
kjer sta n in R količina snovi oziroma plinska konstanta.
Kaj so izoprocesi v plinih?
Kot so mnogi opazili, izobarični, izohorični in izotermični procesi v svojih imenih uporabljajo isto predpono "iso". Pomeni enakost enega termodinamičnega parametra med potekom celotnega procesa, medtem ko se preostali parametri spreminjajo. Na primer, izotermični proces kaže, da je posledično absolutna temperatura sistema konstantna, medtem ko izohorični proces kaže konstantno prostornino.
Izoprocese je priročno preučevati, saj določitev enega od termodinamičnih parametrov vodi do poenostavitve splošne enačbe stanja plina. Pomembno je omeniti, da so bili plinski zakoni za vse te izoprocese odkriti eksperimentalno. Njihova analiza je Clapeyronu omogočila pridobitev reducirane univerzalne enačbe.
Izobarični, izohorični in izotermični procesi
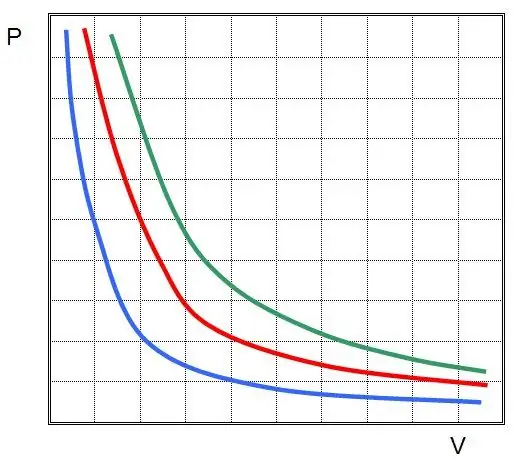
Prvi zakon je bil odkrit za izotermični proces v idealnem plinu. Zdaj se imenuje Boyle-Mariotteov zakon. Ker se T ne spremeni, enačba stanja implicira enakost:
PV=konst.
Z drugimi besedami, vsaka sprememba tlaka v sistemu vodi v obratno sorazmerno spremembo njegove prostornine, če se temperatura plina vzdržuje konstantno. Graf funkcije P(V) jehiperbola.
Izobarični proces - to je sprememba stanja sistema, pri kateri tlak ostane konstanten. Ko smo določili vrednost P v Clapeyronovi enačbi, dobimo naslednji zakon:
V/T=konst.
Ta enakost nosi ime francoskega fizika Jacquesa Charlesa, ki jo je prejel konec 18. stoletja. Izobara (grafični prikaz funkcije V(T)) je videti kot ravna črta. Večji kot je pritisk v sistemu, hitreje se ta črta dviga.
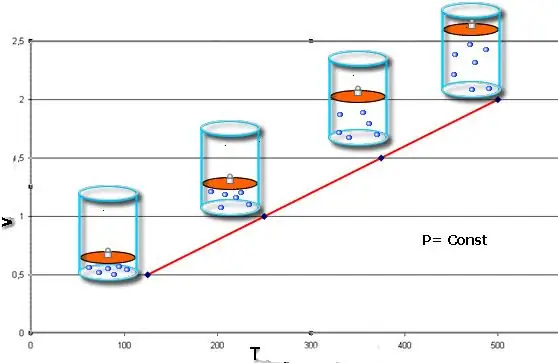
Izobarični postopek je enostavno izvesti, če se plin segreje pod batom. Molekule slednjega povečajo svojo hitrost (kinetično energijo), ustvarijo večji pritisk na bat, kar vodi do raztezanja plina in ohranjanja konstantne vrednosti P.
Nazadnje je tretji izoproces izohoričen. Deluje s konstantno glasnostjo. Iz enačbe stanja dobimo ustrezno enakost:
P/T=konst.
Med fiziki je znan kot Gay-Lussacov zakon. Neposredna sorazmernost med tlakom in absolutno temperaturo kaže, da je graf izohoričnega procesa, tako kot graf izobarnega, ravna črta s pozitivnim naklonom.
Pomembno je razumeti, da se vsi izoprocesi pojavljajo v zaprtih sistemih, to pomeni, da se vrednost n ohrani med njihovim potekom.
adiabatski proces
Ta proces ne spada v kategorijo "iso", saj se med njegovim prehodom spreminjajo vsi trije termodinamični parametri. adiabatskoimenujemo prehod med dvema stanjema sistema, v katerem ne izmenjuje toplote z okoljem. Tako se širitev sistema izvaja zaradi njegovih notranjih energetskih zalog, kar vodi do znatnega padca tlaka in absolutne temperature v njem.
Adiabatski proces za idealen plin opisujejo Poissonove enačbe. Eden od njih je prikazan spodaj:
PVγ=const,
kjer je γ razmerje toplotnih zmogljivosti pri konstantnem tlaku in pri konstantni prostornini.
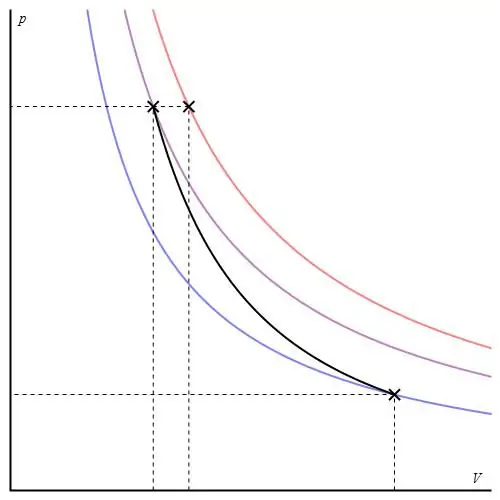
Adiabatni graf se razlikuje od grafa izohoričnega procesa in od izobarnega grafa, vendar je podoben hiperboli (izotermi). Adiabat v osi P-V se obnaša bolj ostro kot izoterma.






