V našem času je fizika postala zelo pogosta znanost. Prisotna je dobesedno povsod. Najbolj elementarni primer: na vašem dvorišču raste jablana in na njej zorijo sadeži, pride čas in jabolka začnejo padati, a v katero smer padajo? Zahvaljujoč zakonu univerzalne gravitacije naš plod pade na tla, torej gre navzdol, ne pa navzgor. Bil je eden najbolj znanih primerov fizike, a bodimo pozorni na termodinamiko, natančneje na fazna ravnovesja, ki niso nič manj pomembna v našem življenju.
termodinamika

Najprej poglejmo ta izraz. ΘερΜοδυναΜική - tako izgleda beseda v grščini. Prvi del ΘερΜo pomeni "toplota", drugi del pa δυναΜική pomeni "moč". Termodinamika je veja fizike, ki preučuje lastnosti makroskopskega sistema, pa tudi različne načine pretvorbe in prenosa energije. V tem razdelku so posebej proučena različna stanja in procesi, da se lahko v opis vnese pojem temperature (to je fizikalna veličina, ki označuje termodinamični sistem in se meri zdoločene naprave). Vsi tekoči procesi v termodinamičnih sistemih so opisani samo z mikroskopskimi količinami (tlak in temperatura ter koncentracija komponent).
Clapeyron-Clausiusova enačba
Vsak fizik pozna to enačbo, vendar jo razčlenimo po delih. Nanaša se na ravnotežne procese prehoda določene snovi iz ene faze v drugo. To se jasno vidi na takih primerih: taljenje, izhlapevanje, sublimacija (eden od načinov konzerviranja izdelkov, ki poteka s popolno odstranitvijo vlage). Formula jasno prikazuje tekoče procese:
- n=PV/RT;
- kjer je T temperatura snovi;
- P-tlak;
- R-specifična toplota faznega prehoda;
- V-sprememba določene količine.
Zgodovina nastanka enačbe

Clausius-Clapeyronova enačba je odlična matematična razlaga drugega zakona termodinamike. Imenuje se tudi "Clausiusova neenakost". Seveda je izrek razvil sam znanstvenik, ki je želel razložiti razmerje med toplotnim tokom v sistemu in entropijo ter njegovim okoljem. To enačbo je razvil Clausius v svojih poskusih razložiti in količinsko opredeliti entropijo. V dobesednem pomenu nam izrek daje možnost, da ugotovimo, ali je ciklični proces reverzibilen ali nepovraten. Ta neenakost nam ponuja kvantitativno formulo za razumevanje drugega zakona.
Znanstvenik je bil eden prvih, ki je delal na ideji entropije in jo je celo dalime procesa. To, kar je danes znano kot Clausiusov izrek, je bilo prvič objavljeno leta 1862 v Rudolfovem šestem delu, O uporabi izreka o enakovrednosti transformacije za notranje delo. Znanstvenik je poskušal prikazati sorazmerno razmerje med entropijo in pretokom energije s segrevanjem (δ Q) v sistemu. V gradbeništvu lahko to toplotno energijo pretvorimo v delo in jo s cikličnim procesom pretvorimo v toploto. Rudolph je dokazal, da je "algebraična vsota vseh transformacij, ki se zgodijo v cikličnem procesu, lahko le manjša od nič ali v skrajnih primerih enaka nič."
Zaprt izoliran sistem
Izolirani sistem je eden od naslednjih:
- Fizični sistem je daleč od drugih, ki ne sodelujejo z njimi.
- Termodinamični sistem je zaprt s trdimi nepremičnimi stenami, skozi katere ne moreta niti materija niti energija.
Kljub dejstvu, da je subjekt notranje povezan z lastno gravitacijo, je izoliran sistem običajno vzet izven meja zunanjih gravitacijskih in drugih oddaljenih sil.
To je lahko v nasprotju s tem, kar (v bolj splošni terminologiji, ki se uporablja v termodinamiki) imenujemo zaprt sistem, obdan s selektivnimi stenami, skozi katere se lahko prenaša energija v obliki toplote ali dela, ne pa snovi. In z odprtim sistemom, v katerem snov in energija vstopata ali izstopata, čeprav ima lahko različne neprepustne stenedeli njenih meja.
Izoliran sistem spoštuje zakon o ohranjanju. Najpogosteje se v termodinamiki snov in energija obravnavata kot ločena pojma.
Termodinamični prehodi
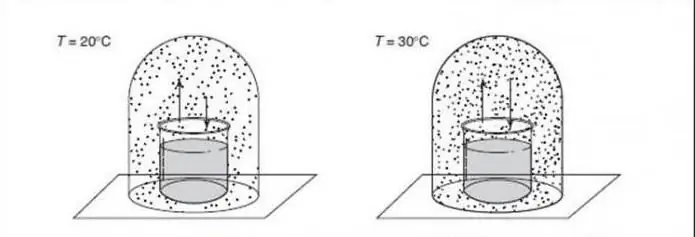
Za razumevanje kvantnih faznih prehodov je koristno, da jih primerjamo s klasičnimi transformacijami (imenovane tudi toplotne inverzije). CPT opisuje vrhunec termodinamičnih lastnosti sistema. Signalizira reorganizacijo delcev. Tipičen primer je prehod zmrzovanja vode, ki opisuje gladek prehod med tekočino in trdno snovjo. Klasične fazne rasti so posledica tekmovanja med energijo sistema in entropijo njegovih toplotnih nihanj.
Klasični sistem nima entropije pri ničelni temperaturi in zato ne more priti do fazne transformacije. Njihov vrstni red je določen s prvim diskontinuiranim izpeljanim termodinamičnim potencialom. In seveda ima prvo naročilo. Fazne transformacije iz feromagneta v paramagnet so neprekinjene in so drugega reda. Te konstantne spremembe iz urejene v neurejeno fazo so opisane s parametrom reda, ki je nič. Za zgornjo feromagnetno transformacijo bo parameter reda skupna magnetizacija sistema.
Gibbsov potencial
Gibbsova brezplačna energija je največja količina dela brez ekspanzije, ki jo je mogoče odstraniti iz termodinamičnega zaprtega sistema (ki lahko izmenjuje toploto in deluje z okoljem). Takšnenajvečji rezultat je mogoče doseči le v popolnoma reverzibilnem procesu. Ko se sistem preoblikuje nazaj iz prvega stanja v drugo, je zmanjšanje Gibbsove proste energije enako tistemu, ki ga izvede sistem v svojem okolju, zmanjšano za delo tlačnih sil.
Stanje ravnotežja

Termodinamično in mehansko ravnotežje je aksiomatični koncept termodinamike. To je notranje stanje enega ali več sistemov, ki so povezani z bolj ali manj prepustnimi ali neprepustnimi stenami. V tem stanju ni čistih makroskopskih tokov snovi ali energije, bodisi znotraj sistema bodisi med sistemi.
V lastnem pojmovanju stanja notranjega ravnotežja se makroskopska sprememba ne zgodi. Sistemi so hkrati v medsebojnem toplotnem, mehanskem, kemičnem (konstantno), sevalnem ravnovesju. Lahko so v enaki obliki. V tem procesu se vsi pogledi shranijo naenkrat in za nedoločen čas, dokler se fizična operacija ne prekine. V makroskopskem ravnovesju potekajo popolnoma natančne uravnotežene izmenjave. Zgornji dokaz je fizična razlaga tega koncepta.
Osnove
Vsak zakoni, izreki, formule imajo svoje temelje. Poglejmo 3 temelje zakona faznega ravnotežja.
- Faza je oblika snovi, homogena po kemični sestavi, fizičnem stanju in mehanskem ravnovesju. Tipične faze so trdna, tekoča in plinasta. Dve tekočini, ki se ne mešata (ali tekoči mešanici z različnimi sestavami), ločeni z ločeno mejo, se štejeta za dve različni fazi in trdni snovi, ki se ne mešata.
- Število komponent (C) je število kemično neodvisnih komponent sistema. Najmanjše število neodvisnih vrst, potrebno za določitev sestave vseh faz sistema.
- Število stopenj svobode (F) v tem kontekstu je število intenzivnih spremenljivk, ki so neodvisne ena od druge.
Razvrstitev po faznih ravnotežjih
- Reakcije neprekinjenega neto prenosa (pogosto imenovane reakcije v trdnem stanju) se pojavijo med trdnimi snovmi različne sestave. Lahko vključujejo elemente, ki jih najdemo v tekočinah (H, C), vendar se ti elementi zadržijo v trdnih fazah, zato tekoče faze niso vključene kot reaktanti ali produkti (H2O, CO2). Trdne reakcije čistega prenosa so lahko neprekinjene ali prekinjene ali končne.
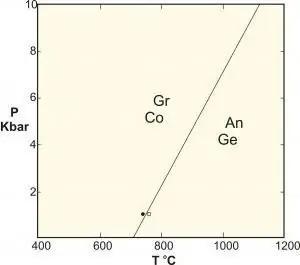
- Polimorfni so posebna vrsta reakcije trdne faze, ki vključuje faze enake sestave. Klasični primeri so reakcije med aluminijevimi silikati kianit-silimanit-andaluzit, pretvorba grafita v diamant pri visokem tlaku in ravnotežje kalcijevega karbonata.
zakoni ravnotežja

Gibbsovo tovarniško pravilo je predlagal Josiah Willard Gibbs v svojem slavnem prispevku z naslovom "Ravnovesje heterogenih snovi", ki se je pojavil od leta 1875 do 1878. Velja zanereaktivni večkomponentni heterogeni sistemi v termodinamičnem ravnotežju in je podana enakost:
- F=C-P+2;
- kjer je F število stopenj svobode;
- C - število komponent;
- P - število faz v termodinamičnem ravnotežju med seboj.
Število stopenj svobode je število nezasedenih intenzivnih spremenljivk. Največje število termodinamičnih parametrov, kot sta temperatura ali tlak, ki se lahko spreminjajo istočasno in poljubno, ne da bi vplivali drug na drugega. Primer enokomponentnega sistema je sistem z eno samo čisto kemikalijo, medtem ko imajo dvokomponentni sistemi, kot so mešanice vode in etanola, dve neodvisni komponenti. Tipični fazni prehodi (fazno ravnotežje) so trdne snovi, tekočine, plini.
Pravilo faze pri konstantnem tlaku
Za aplikacije v znanosti o materialih, ki se ukvarjajo s faznimi spremembami med različnimi trdnimi strukturami, se pogosto pojavi stalen tlak (npr. ena atmosfera) in se zanemari kot stopnja svobode, zato pravilo postane: F=C - P + 1.
Ta formula je včasih predstavljena pod imenom "pravilo kondenzirane faze", vendar kot vemo, ni uporabna za te sisteme, ki so izpostavljeni visokim pritiskom (na primer v geologiji), saj so posledice teh pritiski lahko povzročijo katastrofalne posledice.
Morda se zdi, da je fazno ravnotežje le prazna fraza in malo je fizičnih procesov, v katerih je ta trenutekje vpleten, vendar, kot smo videli, brez njega številni zakoni, ki jih poznamo, ne delujejo, zato se morate malo seznaniti s temi edinstvenimi, barvitimi, čeprav malce dolgočasnimi pravili. To znanje je pomagalo mnogim ljudem. Naučili so se, kako jih uporabiti pri sebi, na primer električarji, ki poznajo pravila za delo s fazami, se lahko zaščitijo pred nepotrebno nevarnostjo.






